Диплом: Генетические основы устойчивости линий и сортов озимой мягкой пшеницы к возбудителю бурой листовой ржавчины Puccinia recondita Rob ex Desm f. sp. tritici
Диплом: Генетические основы устойчивости линий и сортов озимой мягкой пшеницы к возбудителю бурой листовой ржавчины Puccinia recondita Rob ex Desm f. sp. tritici
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ
ОДЕССКИЙ НАЦИОНАЛЬНЫЙ УНИВЕРСИТЕТ им. И. И. МЕЧНИКОВА
БИОЛОГИЧЕСКИЙ ФАКУЛЬТЕТ
Кафедра генетики и молекулярной биологии
ГЕНЕТИЧЕСКАЯ ОСНОВА УСТОЙЧИВОСТИ ЛИНИЙ И СОРТОВ ОЗИМОЙ МЯГКОЙ ПШЕНИЦЫ К
ВОЗБУДИТЕЛЮ БУРОЙ ЛИСТОВОЙ РЖАВЧИНЫ
Puccinia recondita Rob ex Desm f. sp. tritici
ДИПЛОМНАЯ РАБОТА МАГИСТРА
студентки V курса дневного отделения
Залогиной Марии Анатольевны
Научный руководитель:
кандидат биологических наук
старший научный сотрудник
Кожухова Наталия Эдуардовна
Научный консультант:
кандидат сельскохозяйственных наук
старший научный сотрудник
Бабаянц Лазарь Тигранович
Допущена к защите Защищена на
заседании ГЭК
______________2004 г.
___________________2004 г.
Протокол заседания с
оценкой________________
кафедры № _______ Протокол
№______________
Зав. кафедрой Секретарь
ГЭК ___________
_________________
ОДЕССА 2004
РЕФЕРАТ
Дипломная работа изложена на 54 страницах машинописного текста, включает 7
таблиц, 1 рисунок. Список литературы включает 75 работ, из них 48 зарубежных
авторов.
Цель дипломной работы – установить генетическую основу устойчивости озимой
мягкой пшеницы сортов Bayden, Tomo, Welton, и линий 5/37-91 и 2-3/99 к
Puccinia recondita Rob ex Desm f. sp. tritici.
Объект исследований – генетическая детерминация иммунитета растений к инфекциям.
Предмет исследований – гены, обусловливающие устойчивость растений озимой
мягкой пшеницы к бурой листовой ржавчине. Исследования проводились в филиале
кафедры генетики и молекулярной биологии Южного биотехнологического центра в
растениеводстве УААН и МОН Украины, и в отделе фитопатологии и энтомологии
Селекционно-генетического института УААН (г. Одесса).
Изучали устойчивость сортов Bayden, Tomo, Welton, и линий 5/37-91 и 2-3/99 к
патогену, руководствуясь общепринятыми методиками. Проводили гибридизацию,
скрещивали изучаемые сорта и линии с сортами, не имеющими генов устойчивости;
получали семена F1, F2, F1ВС1.
Генетическую основу устойчивости к возбудителю бурой листовой ржавчины
изучали классическим методом гибридологического анализа. Устанавливали
количество генов, их идентичность проверяли, используя тестирующие расы
патогена.
Проведенные исследования позволили установить, что сорта Bayden, Tomo,
Welton и линии 5/37-91 и 2-3/99 обладают устойчивостью к возбудителю бурой
листовой ржавчины. Эти сорта можно использовать в селекции пшеницы как
доноры эффективных Lr-генов.
СОДЕРЖАНИЕ
Введение.............................
1. Обзор литературы.........................
1.1. Общие сведения о бурой листовой ржавчине.............
1.1.1. Цикл развития бурой листовой
ржавчины...........................................
1.2. Специализация и расовый состав....................
1.3. Генетические основы устойчивости пшеницы к
фитопатогенам................................
1.3.1. Гипотеза Флор «ген на ген»....................
1.3.2. Генетические концепции взаимоотношений
растений-хозяев и паразитов.....................
1.3.3. Гены устойчивости и типы их взаимодействий............
1.3.4. Генетические основы типов устойчивости к
фитопатогенам................................
1.3.5. Lr-гены устойчивости к возбудителю бурой листовой
ржавчины...............................
1.4. Селекция на устойчивость к фитопатогенам................
2. Собственные исследования......................
2.1. Материалы и методика......................
2.2. Результаты исследований и их обсуждение.............
Заключение...............................
Выводы................................
Используемая литература.........................
ВВЕДЕНИЕ
Инфекционные болезни растений пшеницы – главная причина снижения урожайности
зерна и ухудшения его качества. Одним из распространенных и вредоносных
заболеваний этой культуры является бурая листовая ржавчина, вызываемая
базидиальным грибом Puccinia recondita Rob ex Desm f. sp. tritici [Гешеле,
1978]. В Украине эпифитотия этого заболевания наблюдается не менее 2-3 раз в
каждые 5 лет [Бабаянц, 1990]. При развитии сильной эпифитотии недоборы урожая
зерна в результате поражения растений этой болезнью могут достигать 40-50%
[Пересыпкин, 1979].
В борьбе с бурой листовой ржавчиной применяются методы интегрированной
защиты, среди которых создание и возделывание устойчивых сортов пшеницы
является основным [Бабаянц, 1988]. К сожалению, устойчивость со временем
теряется. Это связано с тем, что у патогена в результате половой гибридизации
и других парасексуальных процессов появляются вирулентные биотипы и расы,
способные преодолевать эту устойчивость.
Количество эффективных Lr-генов устойчивости к возбудителю бурой листовой
ржавчины с каждым годом сокращается [Бабаянц, 1990; Трасковецька, 1998].
Необходим постоянный поиск таких генов. Он является актуальным и значимым для
селекции.
Источниками эффективных Lr-генов являются сородичи пшеницы – дикие и
культурные виды злаков [Животков, 1993]. Во многих странах, в т.ч. Украине,
ведется селекционная работа по интрогрессии в пшеницу таких Lr-генов в
результате межвидовой гибридизации. Созданные линии и формы пшеницы являются
исходным селекционным материалом и используются в дальнейшем в качестве
доноров устойчивости. Как доноры устойчивости могут использоваться и уже
созданные сорта, как в Украине, так и в других странах.
Для обоснованного использования в селекции доноров устойчивости необходима
информация об их основных признаках и свойствах. Прежде всего, важны сведения
об их генетической основе устойчивости – генах устойчивости, их действии,
взаимодействии, экспрессии, эффективности к наиболее распространенным и
агрессивным расам патогена.
В отделе фитопатологии и энтомологии Селекционно-генетического института
(СГИ) проводится изучение сортов пшеницы различных стран с целью выделения из
них высокоустойчивых к возбудителям различных заболеваний, в т.ч. бурой
листовой ржавчины. В последние годы выделены устойчивые, происходящие из
различных стран сорта.
Целью настоящей работы является установить генетическую основу устойчивости
сортов Bayden, Tomo, Welton (Англия) и линий 5/37-91 и 2-3/99 (СГИ) к
возбудителю бурой листовой ржавчины.
Для достижения поставленной цели, задачами исследований являются:
1. Провести фитооценку устойчивости сортов к вирулентным и наиболее
агрессивным расам патогена
2. Провести гибридизацию и получить семена F1, F2 и F1BC1 для
гибридологического анализа.
3. По результатам фитооценок провести гибридологический анализ.
1. ОБЗОР ЛИТЕРАТУРЫ
1.1. Общие сведения о бурой листовой ржавчине
Царство: Fungi
Класс: Teliomycetes
Порядок: Uredinales
Семейство: Pucciniaceae
Род: Puccinia
Вид: Puccinia recondita
Forma: sp. tritici
Бурая листовая ржавчина – очень распространенное и вредоносное заболевание
пшеницы во многих районах Украины. Частые эпифитотии ее бывают в Лесостепи и
Полесье Украины и на орошаемых землях.
Проявляется главным образом на листьях, реже на листовых влагалищах и очень
редко на стеблях. Сначала преимущественно на верхней стороне листьев
появляются рассеянно (иногда кольцеобразно) ржаво-бурые более или менее
овальные урединии длиной 1 – 2 и шириной 0,5 мм. Они прикрыты эпидермисом,
который вскоре разрывается, обнажая большое количество уредоспор. При сильном
поражении растений урединиями покрывается почти вся листовая пластинка, и
тогда листья скручиваются и быстро усыхают. На растениях сортов с повышенной
чувствительностью к патогену вокруг урединий образуются хлоротические и
нехлоротические пятна. Через10 – 15 дней после появления урединий
преимущественно на нижней стороне листовой пластинки образуются слегка
удлиненные черные телии с телиоспорами, прикрытые эпидермисом.
Возбудитель болезни – двудомный гриб Puccinia reconditа f. sp. tritici Rob
ex Desm. Его уредоспоры шаровидные или эллипсоидальные, 17 – 29 х 16 – 24
мкм, с желто-оранжевым содержимым. Оболочка уредоспор желто-бурая, густо
покрытая маленькими шипиками с узкими проростковыми порами.
Телиоспоры двуклеточные, темно-коричневые, в массе черные, булавовидные, 32 –
49 х 14 – 22 мкм, на вершине их оболочка более темная.
Различают две формы гриба: европейскую и сибирскую. Европейская форма характерна
для Украины. В природных условиях он почти не дает эцидиального спороношения.
Очень редко эцидии с эцидиоспорами можно обнаружить на василистнике (
Tallictrum vulgare) и лещице дымянковидной (Isopyrum fumarioides L.)
В Украине гриб зимует в уредостадии (чаще в виде уредогрибницы) на озимой
пшенице. Заражение пшеницы возможно в широких температурных пределах, так как
уредоспоры при наличии капельной влаги прорастают при температуре от 2,5 до 31
градусов. Оптимальной считается температура 15 - 25 градусов. При наличии росы
и температуре 5 градусов растения заражаются за 7 часов, а при 15 – 20 градусах
менее чем за 4 часа.
Инкубационный период болезни при температуре воздуха 4 – 25 градусов длится
от 18 до 5 дней. За период вегетации пшеницы патоген образует несколько
генераций урединий с уредоспорами, чем и объясняется сильное нарастание
заболевания к началу молочно-восковой спелости растений.
Уредогрибница с уредоспорами, образовавшиеся осенью, относительно стойки к
низким температурам, поэтому заболевание проявляется весной и в дальнейшем
прогрессирует, достигая максимума в фазе молочно-восковой спелости зерна. В
летний период жизнеспособность уредоспор непродолжительна, так как в теплую
погоду и при наличии влаги они быстро прорастают. При высокой температуре и
низкой относительной влажности воздуха уредоспоры быстро теряют
жизнеспособность. В южных районах Украины, в т. ч. в Одесской области, где
между периодом уборки урожая и посевом озимых проходит 1,5 – 3 месяца,
основная масса уредоспор погибает. Здесь источником инфекции являются
зараженные всходы падалицы пшеницы. В более северных районах уредоспоры могут
распространяться из остатков жнивья на новые всходы и заражать их
[Пересыпкин, 1989].
Накоплению инфекционного материала способствуют теплая и влажная погода в
сентябре – октябре предыдущего года, относительно теплая зима, а также
интенсивное выпадение осадков весной и в первой половине вегетации растений в
фазе колошения.
В Сибири гриб зимует в виде телиоспор па пожнивных остатках, а весной
основным источником заражения яровых пшениц являются эцидиоспоры,
образующиеся на лещице дымянковидной и василистнике (сибирская форма).
В условиях Украины основными зонами вредоносности бурой ржавчины являются
Лесостепь и Полесье. Большую угрозу представляет бурая ржавчина и для Юга
Украины. Установлено, что возбудитель бурой листовой ржавчины обладает
широкой специализацией и, кроме пшеницы может развиваться на пырее ползучем,
житняке черепитчатом, костре кровельном, костре мягком, овсянице луговой,
эгилопсе цилиндрическом и обыкновенном, мятлике узколистном.
Роль дикорастущих трав как резерваторов и источников распространения инфекции
возрастает в весенний период, так как развитие ржавчины на них начинается на
7 – 10 дней раньше, чем на посевах пшеницы, а также в период после уборки
стерневых остатков пшеницы до появления всходов озимых.
Вредоносность заболевания проявляется в уменьшении ассимиляционной
поверхности, повышения транспирации с полным нарушением водного баланса, что
является причиной преждевременного отмирания листьев. Пораженные бурой
ржавчиной растения озимой пшеницы с осени имеют слабую зимостойкость,
снижается и их засухоустойчивость. При сильном поражении растений в колосьях
образуется меньше зерен, они имеют низкое качество, легковесны, что является
основной причиной недобора урожая.
1.1.2. Цикл развития бурой листовой ржавчины пшеницы
Цикл развития Puccinia recondita f.sp. tritici ,если его изучать во всех
деталях, представляется в таком виде. Инфицирование злака уредоспорой
происходит всегда через устьице. При прорастании споры образуется аппрессорий,
вслед за тем во внутренней полости устьица, в тесном контакте с внутренней
поверхностью замыкающих клеток, образуется пузыревидное расширение гифы,
заключающее от 4 до 8 ядер. Некоторый процент таких аппрессориев не дает
внутреннего роста, и инфицирование не происходит, о чем можно уже судить по
прошествии 40 часов после нанесения инфекционного материала. Иногда же, при
обилии нанесенных уредоспор, происходит внедрение двух ростков в одно и то же
устьице. Затем развивается инфицирующая гифа, растущая прямо вниз, поперек
воздушной камеры под устьицем, перпендикулярно поверхности листа. Цитоплазма и
ядра из уредоспоры перекочевывают в эту гифу, оставляя упомянутое пузыревидное
вздутие почти пустым. Далее, при соприкосновении гифы, в силу ее роста, с
клеткой мезофилла, в гифе возникает, почти у самого края ее, поперечная
перегородка, дающая начало короткой вершинной клетке, которая, таким образом,
является примордием гаустория. После образования этой клетки в нее переходят 2
-3 из имевшихся ядер, 6 ядер остаются в инфицирующей клетке. Примордий
гаустория образует небольшой гаусторий с одним хорошо образованным ядром.
Интересно заметить, что до известного периода, примерно до 6-го дня нет
никаких ни повреждений питающей клетки мезофилла, ни обеднения ее
содержимого; единственное активное воздействие со стороны паразита
заключается в том, что ядро хозяйской клетки, повинуясь стимулу со стороны
внедряющегося паразита, движется к гаусторию, и последний начинает его
обволакивать. После того инфицирующая гифа, несколько задержанная в своем
развитии образованием гаустория, дает 1 – 2 ветви, которые растут и в свою
очередь разветвляются. Вскоре получается богато разветвленная система гиф.
Содержимое клеток паразита перекочевывает к концам гиф.
Спора имеет 2 ядра, аппрессорий - 2 или больше, субстоматальное пузыревидное
вздутие – 8, инфицирующая гифа – после образования первого примордия
гаустория – большей частью 6. При дальнейшем развитии одно или два ядра
остаются у субстоматального пузыря, остальные ядра делятся, и распределяются
по ветвям мицелия. Молодые гифы часто отличаются неправильным распределением
ядер – их бывает 4, чаще – 3. С течением времени число гаусторий
увеличивается и они одноядерны. По периферии инфекционного пятна на листе
располагаются двуядерные клетки, начинают образовываться двуядерные
уредоспоры. В обычном случае судьба диплоида заканчивается закладкой
телиоспор (последние способны прорастать, но про отсутствии промежуточного
хозяина этот отрезок цикла представляется слепым придатком). Для нормального
прорастания заложившихся телиоспор требуется соблюдение определенных условий
– обязательно зимний период покоя с обязательным воздействием на телиоспоры
всех метеорологических условий, свойственных этому времени года (дождя,
мороза и т. д.). Прорастание базидиоспор происходит обычным путем, с
образованием бесцветных базидий и базидиоспор. Для большинства районов Европы
в т. ч. и для Украины единственным путем сохранения ржавчины из года в год
является ее перезимовка в стадии уредо - с последующим заражением злака.
Чередование форм спороношения находится в определенном сочетании с
чередованием фаз развития, т. е. последовательной сменой гаплоида и диплоида.
У ржавчины на долю гаплоида приходятся следующие стадии: базидиоспоры,
мицелий, образующий спермогонии, сами спермогонии со спермациями. На долю
диплоида приходятся эцидии (сформировавшиеся), эцидиоспоры, мицелий,
образующий уредоспоры, уредоспоры, мицелий, образующий телиоспоры и
телиоспоры. Следовательно, начиная с эцидиоспор, все последующие стадии
развития являются представителями диплоидной фазы.
Таким образом, фаза диплоида значительно преобладает над фазой гаплоида, и
только на ней образуются все виды спор, которые служат для размножения и
расселения вида [Гешеле, 1978].
1.2. Специализация и расовый состав
В процессе сопряженной эволюции паразиты строго специализировались к своим
питающим хозяевам – к родам и видам семейств растений [Вавилов, 1986]. Одни
из них специализировались к паразитированию на определенном роде и виде
растений (узкоспециализированные), другие к паразитированию на различных
видах одного или нескольких семейств (широкоспециализированные). В свою
очередь формы состоят из физиологических рас. Генотипы паразита, одинаково
поражающие наборы сортов – диффунциаторов, фитопатологами были приняты за
основу систематической единицы названной ими «физиологическая раса».
Возбудитель бурой листовой ржавчины Puccinia recondita Rob ex Desm f. sp.
tritici не имеет специализированных форм, в силу узкой специализации вида, и
приходится говорить не о формах, но сразу о физиологических расах бурой
листовой ржавчины [Гешеле, 1979].
Физиологические расы образуются в результате мутаций или рекомбинаций при
половом процессе. Они отличаются одна от другой по наличию генов
вирулентности или их комбинаций, которые могут быть обнаружены по реакции на
растениях-хозяевах. Для анализа рас выделяются моноизоляты, каждый из которых
является потомством одной уредоспоры, состоящим из генетически однородных
биотипов. Расы паразитов определяют с помощью сортовых ключей [Вавилов,
1986].
Первоначально при изучении рас в качестве «тестирующих» были отобраны сорта,
которые вошли в специальные наборы дифференциаторов. Со временем
обнаружилось, что они не могут выявить генетическое разнообразие патогена,
так как не способны охватить всего генетического разнообразия растений-
хозяев. Поэтому к основному набору дифференциаторов добавляют дополнительные
сорта, интересующие селекционеров как доноры устойчивости. Это позволяет
выявить в пределах существующих физиологических рас подрасы (биотипы).
В настоящее время идентифицировано более 200 рас Puccinia recondita Rob ex
Desm f. sp. tritici. [Лесовой, Суворова, 1990]. Специализированные расы
обозначают обыкновенно номерами или буквами. Расы в большинстве случаев
характеризуются определенным географическим ареалом. Состав рас может
меняться из года в год благодаря действию отбора, и возможен занос рас из
других районов [Вавилов, 1986].
Расовый состав Puccinia recondita Rob ex Desm f. sp. tritici, наблюдаемый на
пшенице в степи Украины изучался в Селекционно-генетическом институте. Расы
отличаются частотой встречаемости, вирулентностью – авирулентностью к сортам
и линиям пшеницы с определенными Lr– генами.
До 1996г. доминировала раса 77. В 1997 - 2002 г.г. превалировала раса 144, а
в 2003 – 77 раса бурой листовой ржавчины вновь стала основной.
Из многообразия возникающих в процессе эволюции рас и биотипов более
жизнеспособными оказываются те, которые лучше адаптированы к климатическим
условиям и своим питающим растениям – хозяевам [Бабаянц, 1990].
1.3. Генетические основы устойчивости пшеницы к фитопатогенам.
Селекция сельскохозяйственных культур на устойчивость к возбудителям
инфекционных заболеваний является наиболее актуальной и значимой как наиболее
экономный путь к эффективной защите растений. Вместе с тем экономическая
напряженность в результате интенсивного применения фунгицидов настоятельно
требует широкого внедрения в производство относительно чистых методов борьбы
с болезнями. Среди них возделывание генетически защищенных сортов является
одним из основных. Создание таких сортов – весьма сложное дело, требующее
глубоких знаний о растениях-хозяевах и самих патогенах, закономерностях их
взаимоотношений в зависимости от условий окружающей среды. Наиболее важное
для селекции – представление о генетике устойчивости. Прежде всего,
необходима информация о генах устойчивости, их локализации в хромосомах и
взаимодействии, о наследовании устойчивости и генетическом контроле различных
ее типов. Такая информация позволяет объективно составлять программу
гибридизации и планировать стратегию селекции на иммунитет [Бабаянц, 1990].
1.3.1. Гипотеза Флор «ген на ген»
Растения и возбудители болезней в природе эволюционно тесно связаны и
пригнаны друг другу. Взаимодействие генов растений и паразитов
экспериментально подтвердила американский фитопатолог Флор [Flor, 1956],
выдвинувшая гипотезу «ген на ген». На основе своих исследований Флор сделала
вывод о том, что каждому гену устойчивости или восприимчивости растения-
хозяина соответствует определенный комплементарный ген вирулентности или
авирулентности паразита. Если аллели генов устойчивости и вирулентности
доминантны, то растение устойчиво к болезни. Если же одна из
взаимодействующих аллелей или обе из них находятся в гомозиготном рецессивном
состоянии, то наблюдается восприимчивость к заболеваниям. Исходя из этого,
Флор установила, что гены устойчивости доминантны, а гены вирулентности
рецессивны.
Считают, что в ряде случаев гену устойчивости растения может соответствовать
несколько генов патогенности паразита [Щербаков, 1973]. Возможна обратная
ситуация, когда один ген патогенности соответствует нескольким генам
устойчивости.
Отношения «ген на ген» являются результатом сопряженной эволюции паразита и
растения – хозяина. Длительная совместная эволюция растений – хозяев и
паразитов приводит к развитию взаимной толерантности. Сильно страдающие от
поражения растения не выдерживают конкуренцию с теми, которые страдают
меньше. В результате естественного отбора вид способен повышать свою
выносливость. Генотипы, лучше адаптированные к экологическим условиям среды
оказываются более выносливыми и к поражению болезнями [Гешеле, 1978]. С одной
стороны естественный отбор благоприятствует тем мутациям хозяина, которые
ставят паразита в невыгодное положение. С другой стороны он благоприятствует
тем мутациям паразита, которые усиливают способность паразита к
воспроизводству по сравнению со способностями растения – хозяина. В этом
взаимодействии сначала происходит увеличение частот генов устойчивости, затем
частот генов вирулентности. Последние преодолевают устойчивость хозяина. В
результате такой совместной эволюции между генетическими системами хозяина и
паразита устанавливаются взаимоотношения по принципу «ген на ген».
В процессе эволюции у растений и их паразитов выработались такие механизмы,
которые обеспечивают сохранение генетического материала разнообразия обоих
популяций [Будашкина, Дьяков, 1973].
На основе гипотезы Флор Х. Пирсоном был разработан метод идентификации генов
устойчивости с помощью «тестирующих» рас патогенов с известной вирулентностью
для различных схем хозяин-паразит [Person, 1959]. Вместе с тем некоторые
авторы [Одинцова, Михайлова, 1982] высказали целый ряд ограничений применения
этого метода. Рядом исследователей было показано, что гены устойчивости
могут быть тесно сцеплены, в т. ч. в сложных локусах (полигенный локус) или
близко располагаться в хромосоме с другими генами [Рачинский, 1969; Щербаков,
1973]. При этом в блоки могут входить гены, контролирующие устойчивость к
разным болезням. В результате мутации гена в блоке устойчивость к одним
болезням может сцеплено наследоваться с восприимчивостью к другим [Щербаков,
1973].
В одинаковых локусах гомологичных хромосом может наблюдаться локализация как
одних и тех же генов, так и аллельных, определяющих их различное состояние.
Предполагают, что эволюция генов устойчивости растений к болезням происходит
постепенно или неожиданно в результате эффекта транслокации [Щербаков, 1970].
1.3.2. Генетические концепции взаимоотношений растений-хозяев и паразитов
Многообразие растений-хозяев и паразитов, сложность их взаимоотношений
является причиной того, что до сих пор нет единой теории иммунитета растений
к болезням. Выдвинуто много различных гипотез и теорий, но они приложены к
определенному кругу явлений иммунитета, не охватывая его в целом.
Все известные в настоящее время концепции взаимоотношений растений-хозяев и
паразитов основываются на известных механизмах устойчивости к болезням:
отсутствие в растениях необходимых для паразита питательных веществ,
сверхчувствительность, выделение растениями токсичных ядовитых для паразитов
антибиотических веществ. Взаимодействие белков паразитов и растений-хозяев.
В 1956 году Гарбер, на основе проведенных многочисленных опытов, выдвинул
«питательно-тормозящую» гипотезу иммунитета, Льюис в 1957 – гипотезу
сбалансированного паразитизма и Эфромсон в 1961 – гипотезу «неполной среды».
Эфромсон [Efromson, 1961] предложил генетическую модель (схему) иммунитета,
согласно которой ген восприимчивости растения контролирует синтез фермента,
ответственного за образование необходимых паразиту веществ:
 
ГЕН ХОЗЯИНА ГЕН
ПАРАЗИТА
  БЕЛОК-ФЕРМЕНТ БЕЛОК-ФЕРМЕНТ БЕЛОК-ФЕРМЕНТ БЕЛОК-ФЕРМЕНТ
НЕОБХОДИМЫЙ ПАРАЗИТУ СУБСТРАТ
Эта модель хорошо укладывается в систему Флор «ген на ген», т. е. ген ,
определяющий вирулентность паразита комплементарен гену устойчивости хозяина.
Вторая модель [Laubseher, 1963] основывается на теории регуляции белкового
синтеза Жакоба и Моно. Она предполагает. Что устойчивость контролируется
функциональной системой, состоящей из генов регулятора. Оператора, репрессора
и индуктора. Устойчивость обусловлена действием регуляторных генов растения,
которые репрессируют синтез необходимых паразиту веществ. Ген вирулентности
паразита, в свою очередь, контролирует синтез веществ, блокирующих
репрессор, т.е. снимающих репрессию с синтеза необходимых для паразита
метаболитов. Некоторые исследователи [Дьяков,1965] считают, что эту репрессию
можно также снять средовыми воздействиями на растение, например, повышенными
температурами.
Как считает Метлицкий [Метлицкий, 1976], подход к питательно-тормозящей
гипотезе Гарбера с позиций индуцированной устойчивости позволил бы
значительно расширить представления о защитном механизме растений, который
может состоять не только в отсутствии необходимых паразиту соединений в
питательной ткани, но и исключением из обмена присутствующих в растении
веществ, в ответ на индуцирование авирулентным паразитом или расой.
Питательно-тормозящая гипотеза или гипотеза неполной среды может быть
применена для объяснения иммунитета к высокоспециализированным паразитам,
имеющих высокую степень пригнанности к питающим растениям-хозяевам. В то же
время эта гипотеза вряд ли может быть применена для объяснения иммунитета к
другим возбудителям болезней (например к факультативным сапрофитам). Скорее
всего, она является частной гипотезой, соответствующей некоторым случаям
взаимоотношений растения и паразита
Среди индуцированных гипотез иммунитета, основанных на регуляции белкового
синтеза, следует выделить гипотезу выдвинутую Хайтерфуссом [Heiterfuss,
1965]. Он считает, что взаимоотношения растения-хозяина и паразита
обусловлены действием оператора, репрессора, регулятора растений и эффектора
паразита. Регуляторный ген контролирует синтез репрессора, который,
соединяясь с геном оператором, ингибирует образование защитных веществ. При
введении несовместимого патогена, репрессор, соединяясь с метаболитом
патогена (эффектором), снимает репрессию с гена-оператора, что приводит к
образованию защитных веществ.
При реакции сверхчувствительности цепь биохимических превращений в клетке,
приводящая к образованию фитоалексина, индуцируется специфическим метаболитом
гриба. В незараженной клетке растения репрессор блокирует ген-оператор. При
заражении авирулентной расой специфический метаболит гриба связывает
репрессор и дает возможность оператору включить процесс синтеза специфических
ферментов, участвующих в реакции сверхчувствительности [Дьяков, 1998].
По Фавре [Favret, 1969], гены устойчивости часто сцепленные в изофенные
блоки, контролируют синтез репрессоров. Наряду сгенами, контролирующими
синтез репрессоров, у растения имеется структурный ген, который контролирует
синтез требующихся для паразита питательных веществ. В незараженной клетке
репрессор подавляет транскрипцию структурного гена и питательные вещества не
синтезируются. Паразит может развиваться в том случае, если его метаболиты
снимают репрессию со структурного гена и растение синтезирует для паразита
питательные вещества. Гипотеза Фавре предполагает, что растение устойчиво
ввиду отсутствия в клетках необходимых для паразита веществ, а вирулентность
в результате снятия репрессии со структурного гена приводит к
восприимчивости. Однако заражение авирулентной расой может индуцировать
устойчивость к вирулентной, т.е. делает растение устойчивым к вирулентной
расе. Таким образом, гипотеза Фавре может рассматриваться как частная,
соответствующая некоторым случаям взаимоотношения растений и их паразитов.
Метлицким, Дьяковым и Озерецковской в 1973 году предложена гипотеза «взаимной
индукции» как новая гипотеза иммунитета. Согласно этой гипотезе гены
устойчивости растений контролируют синтез специфических веществ (индукторов),
которые, соединяясь с соответствующими веществами (рецепторами) на мембранах
паразита, освобождают выход метаболитов паразита (индукторы). Последние в
зараженных клетках растения индуцируют фитоалексины. Синтез рецептора
контролируется генами вирулентности. Гены устойчивости растения
непосредственно не участвуют ни в синтезе, ни в регуляции синтеза
фитоалексинов, поскольку при наличии внешнего индуктора любой генотип
обладает способностью к синтезу фитоалексинов. Гены вирулентности
непосредственно не участвуют в синтезе индуктора, поскольку они имеются как у
вирулентных, так и авирулентных рас. Устойчивость к паразиту определяется
скоростью накопления фитоалексина в зараженных клетках до летальной для
паразита концентрации. При заражении вирулентной расой растение не
синтезирует веществ, повреждающих мембрану паразита, или паразит не имеет на
мембранах рецептора связывающего индуктор растения. В этом случае индуктор
паразита не будет вызывать образование фитоалексинов.
Ван дер Планком в 1981 году выдвинута гипотеза иммунитета - «белок на белок».
Сущность этой гипотезы состоит в том, что белковые продукты генов
«восприимчивости» растений и «вирулентности» паразита в процессе патогенеза
способны полимеризоваться. Это обеспечивает паразиту биотрофный тип питания.
Мутация одного из генов «восприимчивости» изменяет структуру соответствующего
белка. Вследствие чего он теряет способность к полимеризации с белком
паразита. Это вызывает защитные реакции у растения и обусловливает
несовместимость растения и паразита. Изменение гена «авирулентности» в ген
«вирулентности» приводит к тому, что кодирующий белок паразита полимеризуется
с белком растения и устанавливается совместимость. Эта гипотеза согласуется с
концепцией Ван дер Планка о вертикальной и горизонтальной устойчивости и
объясняет ее с позиций молекулярной биологии. Концепция Ван дер Планка
выдвинула понятия о больших и малых, майор и минор генах, моно-, олиго- и
полигенах, генах расоспецифической и расонеспецифической устойчивости.
1.3.3. Гены устойчивости и типы их взаимодействий
С тех пор как Биффен опубликовал первые исследования по генетике устойчивости
на основе менделеевских закономерностей [Biffen, 1905, 1907], в мире по этой
проблеме выполнены многочисленные работы. Путем гибридологического анализа
изучена генетическая основа устойчивости многих сортов пшеницы к видам
ржавчины и другим болезням. Установлено, что она контролируется как
доминантными, так и рецессивными генами при независимом, комплементарном,
полимерном, аддитивном и эпистазном их действии и взаимодействии. Обусловлена
моно -, олиго -, или полигенным контролем.
Для обозначения генов устойчивости пшеницы к болезням, по предложению
Ауземуса и его коллег, принята единая система символов по первым буквам
названия болезни на английском языке [Ausemus et al., 1946].
Идентифицировано 44 гена устойчивости к бурой листовой, 45 – к стеблевой,
28 – к желтой ржавчине, 24 – к мучнистой росе, 10 – к твердой головне.
Моносомным и другими методами анализа определена их локализация в хромосомах.
Результаты этих работ нашли отражение в многочисленных научных трудах,
которые обобщены и систематизированы Макинтошем в каталоге генетических
символов пшеницы [McIntosh, 1998]. В СГИ в результате многолетних
исследований выявлены сорта пшеницы и гены устойчивости к видам ржавчины и
другим патогенам. Они могут быть использованы при создании устойчивых к
болезням сортов [Бабаянц, 1990].
1.3.4. Генетические основы типов устойчивости к фитопатогенам
Основанием для современного подразделения устойчивости на типы являются
исследования биологической специализации паразитов, физиолого-биохимических,
генетических и эпидемиологических взаимоотношений в системе «патоген -
хозяин» в определенных условиях среды. Эти исследования позволили
фитопатологам выдвинуть понятие о 2-х типах устойчивости – «специфической»
или вертикальной и «неспецифической» или горизонтальной [Ван Дер Планк,
1972].
Вертикальная устойчивость может обеспечивать полную защиту от болезни, и
обычно эффективна против одних рас паразита и неэффективна против других. Она
может оказывать сильное давление на популяцию паразита, приводя или к
накоплению вирулентных патотипов, или к возникновению новых рас с новыми
генами вирулентности [Watson, Luig, 1968].
В некоторых случаях вертикальная устойчивость может изменяться в зависимости
от температурных и световых условий. Она может действовать на всех этапах
онтогенеза и быть высокой или умеренной. Эта устойчивость контролируется моно
- или олигогенами и часто обусловлена реакцией сверх чувствительности
[Гешеле, 1978].
Фитопатологическим проявлением неспецифической устойчивости является слабая
или умеренная пораженность растений независимо от расового разнообразия
паразита, т.е. эта устойчивость одинаково проявляется по отношению ко всем
расам патогена. Неспецифическая устойчивость снижает эффект инфекции после
того как она произошла. Болезнь на сортах с таким типом устойчивости может
развиваться медленно и урожай при этом существенно не снижается.
Неспецифическая устойчивость не обеспечивает полной защиты хозяина, но она
более стабильная.
Устойчивость к болезням должна быть относительно стабильной и обеспечивать
защиту сортов и гибридов на период возделывания их в производстве. Длительно
– сохраняющейся и стабильной может быть как олигогенная вертикальная, так и
полигенная горизонтальная устойчивость.
Более длительно устойчивыми могут также быть сорта, сочетающие вертикальную
устойчивость с горизонтальной, т.е. многобарьерные [Донцев, 1976].
Устойчивость к патогену может определяться генами разных локусов с одинаковым
действием. Они могут быть доминантными и рецессивными. Также могут быть тесно
сцеплены в сложных локусах или близко располагаться в хромосоме с другими
генами. Гены устойчивости могут быть сцеплены с генами, ответственными за
другие признаки и свойства растений [Рачинский, Донцев, 1969; Попереля,
Бабаянц, 1978].
На различных этапах онтогенеза растений могут действовать одни и те же или
разные гены, ответственные за устойчивость [Бабаянц, Слюсаренко, 1981].
Поэтому различают проростковые, или ювенильные, и возрастные гены
устойчивости. Ювенильные гены чаще всего действуют во все фазы развития
растения, а возрастные – только с определенной фазы взрослого растения.
Действие генов устойчивости пшеницы к болезням может зависеть от генетической
среды, в которой они находятся [Бабаянц, Слюсаренко, 1985]. На действие генов
устойчивости пшеницы к болезням оказывают влияние внешние условия, прежде
всего температура. Имеется многочисленная информация об изменении типа и
интенсивности поражения растений видами ржавчины и другими болезнями в
зависимости от температуры [Одинцова, Пеуша, 1984].
У растений разных сельскохозяйственных культур идентифицировано большое число
генов устойчивости к болезням. Принята общая международная классификация
символов и описания генов.
У пшеницы гены устойчивости к бурой листовой ржавчине называются «Lr»-гены от
английского Leaf rust – листовая ржавчина. Эту номенклатуру символов
предложил Бригл [Briggle, 1966].
1.3.5. Lr-гены устойчивости к возбудителю бурой листовой ржавчины
В настоящее время идентифицировано 44 гена устойчивости пшеницы к возбудителю
бурой листовой ржавчины Puccinia recondita Rob ex Desm f. sp. tritici. Они
занесены Макинтошем в каталог генов устойчивости пшеницы к возбудителям
инфекционных заболеваний и вредителям [McIntosh, 1998].
Обширная информация об Lr-генах представлена в работе Макинтоша, Веллинга и
Парка [McIntosh, Welling, Park, 1995]. В ней указано, что Lr1, Lr2, Lr3
впервые идентифицировал Ауземус в 1946 году [Ausemus et al., 1946]. Гены
локализованы: Lr1- в хромосоме 5D [McIntosh et al., 1965], Lr2- в 2DS, Lr3- в
6B. Lr2 имеет три аллели- a, b, c. Носителями Lr1 являются сорта Малакоф,
Сонора 64, Тобари 66, а Lr2а – Медитеранеан, Демократ, Lr2b – Карина, Lr2c-
Бревит и Лорос. Ген Lr3 имеет три аллели: a, bg, ka. Lr3a имеют сорта
Демократ, Медитеранеан, Кук, Хана, Безостая1, Мироновская 808; Lr3bg – Баге,
Lr3ka – Клейн Аниверсарио.
Гены Lr4, Lr5, Lr6, Lr7 и Lr8 идентифицированы Пирсом в 1961 г .
Lr9 интрогрессирован в пшеницу из Aegilops umbellulatum. Макинтошем
установлено, что этот ген локализован в хромосоме 6В [McIntosh et al., 1965].
Носителями этого гена являются сорта Трансфер, Абе, Артур 71, Оазис, Кокер.
Lr10 впервые идентифицирован Андерсоном в 1961 году [Anderson et al., 1961].
Он локализован в хромосоме 1А [Dyck and Kerber, 1971]. Носителями этого гена
являются сорта Ли, Габо, Селкирк и многие другие.
Lr11 впервые идентифицировал Солиман в 1958 году. Он локализован в хромосоме
2А [Soliman et al.,1964]. Носители этого гена сорта Болгария 88, Оазис и
другие.
Lr12 впервые идентифицировал Дик в 1966 году [Dyck et al., 1966]. Он
локализован в хромосоме 4В [McIntosh and Baker., 1966] и имеется у сортов
Опал, Чайниз Спринг и других.
Lr13 также идентифицирован Диком в 1966 году. Он локализован в хромосоме 2BS
[Hawthorn and McIntosh, 1981 и имеется у сортов Маниту, Ред Бобс, Атлас66,
Фронтана.
Lr14 идентифицирован Макинтошем в 1967году. Он локализован в хромосоме 7В и
имеет два аллели a, b. [McIntosh et al., 1967]. Этот ген имеется у сортов
Хоуп, Селкирк, Мария Эскобар, Бовие и других.
Lr15 также идентифицировал Макинтош в 1968 году. Он локализован в хромосоме
2D [Luig and McIntosh, 1968]. Этот ген имеет сорт Кения w1483.
Lr16 идентифицировал Самборский в 1968 году [Samborsky et al., 1968]. Он
локализован в хромосоме 4В [Dyck and Kerber, 1971] , этот ген имеют сорта
Эксчендж, Циано 79, Этуаль де Шуази и другие.
Lr17 идентифицировали Дик и Самборский в 1968году. Он локализован в хромосоме
2AS [Dyck and Kerber., 1977] и имеется у сортов Клейн Люцеро, Торим 73, Инуа
66 и других.
Lr 18 также идентифицировали Дик и Самборский в 1968году. Локализован в
хромосоме 5BL [McIntosh., 1983]. Носителями этого гена являются сорта Южная
Африка 43, PI.159106 и другие.
Lr19 впервые интрогрессировал в пшеницу Броудер [Browder, 1972] в пшеницу от
Agropyron elongatum в 1972году. Локализован в хромосоме 7DL [Sharma and
Knott., 1972] и имеется у сортов Агата, Агрус и других.
Lr20 впервые идентифицирован Броудером в 1972г. Локализован в хромосоме 7AS
[Sears and Briggle, 1968] и имеется у сортов Аксминстер, Тью, Кения w 744,
Нормандия, Тиммо, Морис Хальберд и других.
Lr21 интрогрессирован в пшеницу из Aegilops taushii в 1974 году [Rowland and
Kerber, 1974]. Он локализован в хромосоме 1D [Kerber and Dyck, 1979] и
присутствует у сортов Тетра Кантач, Р.Л.5406 и других. Впервые
идентифицирован Роуландом и Кербером в 1974году.
Lr22 Идентифицирован также Роуландом и Кербером в 1974году. Существуют два
аллели этого гена- a и b [Dyck, 1979]. Локализованы они в хромосоме 2DS. Ген
присутствует в сортах Lr22a-R.L.6044, R.L.5404; Lr22b- Маниту и других.
Lr23 Обнаружен Макинтошем и Диком в 1975году. Локализован в хромосоме 2BS и
обнаружен в сортах Кранбрук, Мадлен, Канна и других [McIntosh, Dyck, 1975].
Lr24 Впервые открыт Макинтошем в 1976году [McIntosh et al., 1976]. Находится
в хромосоме 3D [Smith et al., 1968]. Имеется в сортах Торрес, Васко, ТАМ200,
Кокер и других.
Lr25 Также идентифицирован Макинтошем в 1988году [McIntosh, 1988]. Ген
локализован в хромосоме 4BS [Driscoll et al., 1967]. Присутствует у сортов
Трансфер и других.
Lr26 Идентифицировал Макинтош в 1988году. Находится в хромосоме 1В [Mettin et
al., 1973]. Его имеют сорта Аврора, Кавказ, Селекта, Скороспелка 35, Эксель,
Алондра и другие.
Lr27 Обнаружен Макинтошем и Сингом в 1984году [Singh, McIntosh, 1984]. Этот
ген комплементарно взаимодействует с Lr31. Находится в хромосоме 4BS.
Имеется в сортах SUN27A, Тимгален, Сарагоса, Юпатеко и других.
Lr28 в 1982 году идентифицирован Макинтошем. Локализован в хромосоме 4AL и
обнаружен в сорте Санленд и других.
Lr29 Открыл Макинтош в 1988году [McIntosh et al., 1988]. Он локализован в
хромосоме 7DS и имеется в сортах Тетчер*6//СS, R.L.6080 и других.
Lr30. идентифицирован Диком и Кербером в 1981году, он локализован в хромосоме
4АL [Dyck, Kerber, 1981]. Обнаружен в сортах Тетчер*6/Терензио, P.I.269250.
Lr31 Обнаружен Сингом и Макинтошем, как комплементарно взаимодействующий с
Lr27 и локализован в хромосоме 4BS и имеется в тех же сортах, где и Lr27.
Lr32 Идентифицирован Кербером в 1987 году [Kerber, 1987]. Находится в
хромосоме 3D. Был найден в сортах Тетра Кантач, Тетчер*7//R.L.5497 b
Lr33 впервые обнаружен Диком в 1987 году. Локализован в 1В хромосоме [Dyck et
al., 1987], имеется в сортах Тетчер*6/P.I.58548, P.I.125387 и других.
Lr34 также идентифицирован Диком в 1987году. Он локализован в хромосоме 7D,
найден в сортах Чайниз Спринг, Пеньямо, Эсмеральда86, Виктория81 и других.
Lr35 обнаружен впервые Кербером и Диком в 1990 году. Он локализован в
хромосоме 2В [Kerber, Dyck, 1990]. Имеется в сортах Маркус-К*8/R.L.5347,
R/L/5711, и другие.
Lr36 открыт Двораком и Кноттом в 1990 году. Ген находится в хромосоме 6BS
[Dvorak, Knott, 1990]. Имеется в сортах Ниипауа*5Т, Маниту и в других.
Lr37 впервые идентифицирован в 1991году Барианой [Bariana, McIntosh, 1991].
Локализован в хромосоме 2AS. Находится в сортах Трайдент, Санбрай.
Lr38 Идентифицирован в 1992 году Фрибе [Friebe et al., 1992]. Хромосомная
локализация еще не установлена. Он происходит от Agropyron intermedium.
Обнаружен в сортах Тэтчер*6/Т7, R.L.6097.
Lr39, Lr40, Lr41, Lr42, Lr43 происходят от Triticum tauschii. Впервые
идентифицированы Коксом в 1994 году [Cox et al., 1994].
Lr 44 обнаружен Диком в 1993 году. Источником этого гена является Triticum
tauschii. Ген локализован в хромосоме 1В [Dyck, 1993].
По данным отдела фитопатологии и энтомологии СГИ в Украине эффективными
генами являются Lr9, Lr19, и Lr43, частично эффективными – Lr24, Lr37. Все
остальные гены являются слабо эффективными или не эффективными. Анализ
информации о носителях Lr-генов показывает, что среди них отсутствуют сорта
Bayden, Welton, Tomo, линии 5/37-91 и 2-3/99, т.е. генетическая основа их
устойчивости к возбудителю бурой листовой ржавчины не изучена. Линия 5/37-91
получена в СГИ в результате межвидовой гибридизации сорта озимой мягкой
пшеницы Одесская полукарликовая и Aegilops cylindrica [Бабаянц, Рыбалка,
Аксельруд, 2001]. Линия 2-3/99 получена в результате аллогамной гибридизации
между сортами озимой мягкой пшеницы [Бабаянц, Литвиненко, Трасковецька,
2001].
В Связи с вышеизложенным, научно-исследовательская работа по теме
«Генетическая основа устойчивости линий и сортов пшеницы к возбудителю бурой
листовой ржавчины Puccinia recondita Rob ex Desm f. sp. tritici» является
актуальной, отличается новизной и имеет практическое значение для селекции
пшеницы на устойчивость к возбудителю этого заболевания.
1.4. Селекция на устойчивость к фитопатогенам
Селекция растений на устойчивость к болезням – сложный, многоступенчатый и
беспрерывный процесс. Создаваемые сорта и гибриды сельскохозяйственных
культур должны также обладать хорошим качеством продукции, высокой
урожайностью и другими ценными показателями.
Устойчивость к болезням должна быть относительно стабильной и обеспечивать
защиту сортов и гибридов на период возделывания их в производстве. Многие
исследователи считают, что длительно сохраняющейся и стабильной может быть
как олигогенная вертикальная, так и полигенная горизонтальная устойчивость.
Такой устойчивостью, обусловленной «большими» генами и направленной против
определенных групп патогенов, могут обладать конвергентные сорта. Для
создания конвергентных сортов наибольшую ценность имеют гены устойчивости с
широким спектром действия. Более длительно устойчивыми могут быть также
сорта, сочетающие вертикальную устойчивость с горизонтальной, т.е.
многобарьерные сорта.
Одним из вариантов эффективного использования генов расоспецифической
устойчивости является создание мультилинейных сортов. Такие сорта состоят из
фенотипически сходных линий, несущих различные гены устойчивости. Они
поддерживают стабильность рас в популяциях паразита, снижают скорость
нарастания инфекции, т.е. моделируют процессы, происходящие в природных
популяциях. В случае поражения какой-то линии, она может быть заменена
другой. Такие сорта можно легко модифицировать. Болезнь на них развивается
как на сортах с горизонтальной устойчивостью. Эффективность определенного
типа устойчивости при создании стабильноустойчивых сортов и гибридов пшеницы
зависит от того, против какого возбудителя болезни она направлена, какова
скорость его изменчивости, образования вирулентных патотипов и
распространения инфекции. Она также зависит от силы и продолжительности
эпифитотии, условий окружающей среды и других факторов.
Большинство селекционеров и фитопатологов выступают за генетическое
разнообразие и против генетической узости сортов. Уязвимость сортов, частые
вспышки массовых эпифитотий являются следствием генетической однородности
сортов и использования в селекции одних и тех же или ограниченного числа
генов устойчивости [Кривченко, 1981].
Выбор метода селекции определяется поставленными задачами, имеющимися в
распоряжении селекционеров и фитопатологов материально-технической базы и
другими условиями.
В настоящее время при селекции растений на устойчивость к болезням
используются методы гибридизации, мутагенеза и отбора. Селекционерами
используются простые и сложные, внутривидовые, межвидовые, отдаленные
скрещивания, химические и физические мутагены. Отборы устойчивых генотипов
растений проводятся на фонах естественных и искусственных эпифитотий в
обычных селекционных посевах и специальных полевых питомниках, в условиях
закрытого грунта (теплицы, оранжереи, климатические камеры) и лабораторий
[Гешеле, 1978; Бабаянц 2001].
При простых скрещиваниях возможно получение устойчивых генотипов и, даже,
трансгрессий устойчивости за счет взаимодействия генов родительских форм.
Однако селекционерами чаще всего используются полные и неполные беккроссы,
ступенчатые, конвергентные и другие виды сложных скрещиваний. Это связано со
следующими причинами. Чем больше признаков и свойств прорабатывается
селекционером, тем сложнее программа гибридизации. Часто устойчивость к
болезням сцеплена с рядом отрицательных признаков и свойств и наследуется с
ними. Или у гибридов вместе с устойчивостью наблюдается промежуточное
наследование других основных признаков и свойств. Это вызывает необходимость
повторных скрещиваний промежуточных форм с хозяйственно ценными. Такое чаще
всего наблюдается в том случае, когда в качестве доноров устойчивости
используются недостаточно отработанные формы от межвидовой и межродовой
гибридизации. Некоторые из таких форм могут нести даже признаки исходных
дикарей.
Сложная гибридизация используется при селекции на групповую или комплексную
устойчивость к болезням и вредителям. Методом беккроссов можно создать
устойчивые к болезням аналоги поражаемых сортов или близких к ним линий. Он
является основным методом селекции на расоспецифическую устойчивость. Однако
гены могут обладать различной способностью передавать устойчивость при
многократных скрещиваниях с восприимчивым сортом [Смирнова и др., 1977]. В
некоторых случаях при беккроссах и других повторных скрещиваниях с
восприимчивыми сортами, когда гены устойчивости наследуются независимо друг
от друга, селекционеры отбирают формы с меньшей или обедненной устойчивостью.
Такие формы обладают меньшим числом генов устойчивости, но в некоторых более
удачно могут сочетаться другие ценные признаки и свойства. Если донор
обладает многими несцепленными в блоки малыми генами, то при беккроссах
устойчивость обусловленная ими распадается.
У самоопыляющихся культур при ступенчатых скрещиваниях (прерывистые,
беспрерывные) представляется возможность решения нескольких задач. Возможно
объединение в одном генотипе устойчивости всех участвующих в гибридизации
родительских форм к одной или нескольким болезням. Можно получить новую
устойчивость или ее трансгрессию за счет полимерного, аддитивного,
комплементарного и других взаимодействий генов и действия генов
модификаторов.
При селекции многобарьерных и конвергентных сортов, обладающих различными
типами устойчивости, действие малых генов может быть маскировано действием
больших генов устойчивости. В этом случае необходимо иметь вирулентные к
большим генам расы-биотипы-патотипы, на фоне которых можно выявить действие
других генов. Если таких патотипов не имеется, то в процессе селекции можно
потерять устойчивость обусловленную малыми генами. Этот случай был назван Ван
дер Планком (1966) «эффектом Вертифолии». Аналогичная необходимость в
вирулентных к различным генам устойчивости «тестирующих» расах возникает при
конвергентной селекции. При отсутствии таковых можно использовать различные
маркеры генов устойчивости [Попереля, Бабаянц, 1978]. Для определения числа
генов устойчивости в селектируемых линиях можно пользоваться методом
гибридологического анализа.
При селекции перекрестноопыляющихся культур на устойчивость к болезням
селекционеры широко применяют инбридинг или рекуррентную селекцию. Последняя
состоит из чередующихся инбридингов и аутбридингов. Эти методы позволяют
сконцентрировать в линиях и гибридах гены как с аддитивным, так и с
неаддитивным эффектом. Возможны и другие типы скрещиваний (беккросс,
синтетические и др.).
Дикие сородичи культурных растений являются источниками устойчивости растений
ко многим болезням. В научной литературе имеются многочисленные примеры
успешного переноса с помощью отдаленной гибридизации устойчивости к
заболеваниям от отдельных видов в большинство сельскохозяйственных культур.
Значимость отдаленной гибридизации при селекции на иммунитет возрастает, т.к.
с каждым годом все острее возникает потребность в новых эффективных генах
устойчивости. Возможности ее значительно повысились в связи с унификацией и
разработкой методов преодоления нескрещиваемости, использованием для этих
целей культуры клеток и тканей и других достижений.
При селекции на устойчивость к болезням применяются массовый и индивидуальный
отборы. Они могут применяться как самостоятельно, так и чередоваться с
гибридизацией и другими методами. В этих случаях индивидуальный отбор (метод
Педигри) является основным.
2. СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ
2.1 Материалы и методика
Изучали генетическую основу устойчивости сортов озимой мягкой пшеницы Bayden,
Tomo и Welton (Англия), линий 5/37-91 (Одесская полукарликовая х Aegilops
cylindrica), 2-3/99 ((Grana x Agatha) x Michigan Amber) к возбудителю бурой
листовой ржавчины Puccinia recondita Rob ex Desm f. sp. tritici. Линии
созданы в Селекционно-генетическом институте.
Bayden относится к разновидности лютесценс, является полукарликовым
высокопродуктивным сортом. Обладает высокой устойчивостью к возбудителям
мучнистой росы, бурой листовой и желтой ржавчины, септориоза.
Tomo относится к разновидности лютесценс, является полукарликовым
высокопродуктивным сортом. Обладает высокой устойчивостью к возбудителям
мучнистой росы, бурой листовой и желтой ржавчины, септориоза, фузариоза
колоса.
Welton относится к разновидности лютесценс, является полукарликовым
высокопродуктивным сортом. Обладает высокой устойчивостью к возбудителям
мучнистой росы, бурой листовой и желтой ржавчины.
Линия 5/37-91 является полукарликовой, относится к разновидности
эритроспермум. Обладает высокой устойчивостью к возбудителям мучнистой росы,
бурой и стеблевой ржавчины, твердой и пыльной головни, септориоза и фузариоза
колоса.
Линия 2-3/99 является полукарликовой, относится к разновидности
эритроспермум. Обладает устойчивостью к возбудителям мучнистой росы, бурой и
стеблевой ржавчины, септориоза.
При изучении генетики устойчивости вышеуказанных сортов и линий к возбудителю
бурой листовой ржавчины в гибридизации в качестве рекуррентной родительской
формы использован сорт озимой мягкой пшеницы селекции СГИ Одесская
полукарликовая. Одесская полукарликовая относится к разновидности
эритроспермум и является высокопродуктивным сортом. Обладает хорошей засухо-
и зимостойкостью. По качеству зерна относится к ценным пшеницам. Поражается
большинством возбудителей листостебельных болезней сильно, в т. ч. бурой
листовой ржавчины. Имеет ген Lr2b, однако в Украине этот ген эффективностью
ко всем основным расам патогена, не обладает [Крижановский, Лозийчук, 1983].
Характеристика дана по материалам изучения этих сортов в отделе фитопатологии
и энтомологии СГИ.
Генетическую основу устойчивости к возбудителю бурой листовой ржавчины
изучали классическим методом гибридологического анализа, описанного Лобашевым
М.Е. и Тоцким В.Н. в учебниках генетики [Лобашев, 1963; Тоцький, 1998].
В работе по организации и проведении исследований руководствовались
методиками, описанными в сборнике «Методы селекции и оценки устойчивости
пшеницы и ячменя к болезням в странах-членах СЭВ» [Бабаянц и др., 1988].
От скрещивания сортов Bayden, Tomo, Welton и линий 5/37-91 и 2-3/99 с сортом
Одесская полукарликовая получили семена F1, F2 и F1BC1. Растения гибридов и
их родителей выращивали в вазонах в теплице отдела фитопатологии и
энтомологии СГИ. Отрезок первого листочка каждого растения помещали в
растильни на фильтровальную бумагу, смоченную 0,04% раствором бензимидазола.
Их инокулировали с помощью микробиологической петли суспензией уредоспор рас
2 (изолят 2), 77 (изолят 29), 77 (изолят15), 144 (изолят 97) возбудителя
бурой листовой ржавчины.
На Юге Украины расы 77 и 144 являются доминирующими.
Первая из них авирулентна к носителям генов Lr9, Lr19, Lr43, вторая – к
Lr2a, Lr9, Lr19, Lr43. После инокуляции, растильни помещали в инкубационную
камеру на 24 часа без освещения с температурой 18-20 градусов. Далее
растильни переносили в светоустановку, имеющую освещенность 4000 люкс.
Освещали круглосуточно при температуре 18-20 градусов. После полного
проявления уредопустул на отрезках листьев, проводили учет типов реакций на
инфекцию патогена в баллах, характеризующих устойчивость (R) и
восприимчивость (S). Их устанавливали по модифицированной шкале Майнса и
Джексона. (Рис.1). По этой шкале баллы 0,0; 1,2 и Х - характеризовали
устойчивость, 3, 4 и Х+ - восприимчивость. Оценивали растения F1 в сравнении
с родительскими формами гибридов, а в F2 и F1BC1 устанавливали характер
расщепления по соотношению устойчивых и восприимчивых растений.
Устойчивость взрослых растений (фаза молочно-восковой зрелости) оценивали по
интегрированной шкале оценок устойчивости зерновых колосовых культур к
возбудителям листовых форм ржавчины (Табл. 1).
Достоверность соответствия фактического расщепления теоретически ожидаемому,
устанавливали по показателю χ2, который определяли по формуле:
χ2 = 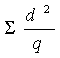 . .
По этой формуле d – отклонение полученных данных от теоретически ожидаемых
для каждого класса; q – теоретически ожидаемые величины [Рокицкий, 1979].
Таблица 1
Интегрированная шкала оценок устойчивости зерновых колосовых культур к
Puccinia recondita Rob ex Desm f. sp. tritici, Puccinia dispersa, Puccinia
hordei, Puccinia coronifera.
| Балл | Характер проявления болезни | Степень устойчивости, восприимчивости | | 9 | Признаки болезни отсутствуют | Очень высокая и высокая устойчивость | | 8 | На листьях одиночные хлорозные и некрозные пятна возможно с очень мелкими уредопустулами и интенсивностью до 5% | 7 6 | Мелкие и средние уредопустулы, возможно в хлорозных и некрозных пятнах, интенсивностью до 10% | Устойчивость | | 6 | Мелкие и средние уредопустулы, возможно в хлорозных и некрозных пятнах, интенсивностью до 15% | | 5 | Интенсивность уредопустул до 25%, возможно со слабым хлорозом и некрозом | Слабая восприимчивость | | 4 | Средние, крупные уредопустулы интенсивностью до 40%, возможно со слабым хлорозом | Восприимчивость | | 3 | Интенсивность уредопустул до 65% | | 2 | Крупные сливающиеся уредопустулы интенсивностью до 90% | Высокая и очень высокая восприимчивость | | 1 | Крупные сливающиеся уредопустулы интенсивностью 100% |
2.2. Результаты исследований и их обсуждение
Сорта Bayden, Tomo, Welton, линия 5/37-91 в ювенильной фазе ко всем
тестируемым расам Puccinia recondita f. sp. tritici проявили устойчивость.
Линия 2-3/99 в этой фазе развития растений проявила устойчивость к расам 2
(изолят 2) и 77 (изолят 15), восприимчивость к расам 144 (изолят 97) и 77
(изолят 15) (Табл.2). Однако сорта и линии в фазе молочно-восковой спелости
ко всем расам патогена проявили различную степень устойчивости (Табл.3). В
то же время моногенные линии и сорта с генами Lr1, Lr2b, Lr2c, Lr3a, Lr3bg,
Lr3ka, Lr10, Lr11, Lr12, Lr13, Lr14a, Lr14b, Lr16, Lr17, Lr18, Lr20, Lr21,
Lr22, Lr23, Lr25, Lr29, Lr30, Lr32, Lr34 проявили восприимчивость; линия с
геном Lr19 была устойчива к расам 2 (изолят 2) и 77 (изолят 29), восприимчива
к расам 144 (изолят 97) и 77 (изолят 15). Это указывает на то, что гены
сортов Bayden Tomo, Welton и линии 5/37-91 неидентичны выше перечисленным Lr
генам.
Линии Webster/6Tc с геном Lr2a, Tc6 / Agent с Lr24 и сорт Кавказ с Lr26
восприимчивы к расе 77 (изолят 15), в то время как сорта Bayden, Tomo,
Welton, и линия 5/37-91 (табл. 1) к ним устойчивы. Это указывает на то, что
гены этих сортов и линий неидентичны генам Lr2a, Lr24 и Lr26.
Сорт Transfer с геном Lr9, линия Tc6 / Kenya W 1483 c геном Lr15 к расе 77
(изолят 15) восприимчивы, а Welton, Tomo, Bayden и линия 5/37-91 к ней
устойчивы. Это значит, что гены Bayden, Tomo, Welton и линии 5/37-91
неидентичны генам Lr9 и Lr15.
Линия Tc 7/ Agatha с геном Lr19 восприимчива к расам 144 (изолят 97) и 77
(изолят 15), а сорта Bayden Welton , Tomo и линия 5/37-91 к ним устойчивы.
Следовательно, их гены неидентичны гену Lr 19. В то же время одинаковые
показатели оценок устойчивости моногенной линии с геном Lr 19 и линии 2-3/99,
указывает на то, что Lr-гены этих линий идентичны.
Сорт Rendezvous с геном Lr37 восприимчив к расам 144 (изолят 97) и 77 (изолят
29), а сорта Welton Tomo , Bayden и линия 5/37-91 к ним устойчивы. Значит их
гены неидентичны гену Lr37.
Таблица 2
Реакция линий и сортов пшеницы на тестирующие расы возбудителя бурой листовой
ржавчины Puccinia recondita f. sp. tritici.
Ювенильная фаза 2002г
| Линия, сорт | Lr- ген | Раса / изолят | | 2/2 | 77/29 | 144/97 | 77/15 | | Centenario /6 Tc | 1 | R | S | S | S | | Webster / 6 Tc | 2a | R | S | R | S | | Tc6 / Carina | 2b | R | S | S | S | | Tc6 / Loros | 2c | R | S | S | S | | Democrat / 6 Tc RL 6002 | 3a | S | S | S | S | | Klein Aniversario / Tc | 3ka | S | S | S | S | | Bage / 8 Tc | 3bg | S | S | S | S | | Transfer | 9 | R | R | R | S | | Exchange / 6 Tc | 10 | S | S | S | S | | Tc6 / Hussar | 11 | R | S | S | S | | Exchange / 6 Tc | 12 | S | S | S | S | | Tc7 / Frontana | 13 | S | S | S | S | | Selkirk / 6 Tc | 14a | S | S | S | S | | Mario Escobar/6Tc | 14b | S | S | S | S | | Tc6 / Kenya W1483 | 15 | R | MR | R | S | | Exchange / 6 Tc | 16 | S | S | S | S | | Klein Lucero / 6Tc | 17 | S | S | S | S | | South Africa 43 / 7Tc | 18 | S | S | S | S | | Tc7 / Agatha | 19 | R | R | S | S | | Axminster / 6Tc | 20 | S | S | S | S | | Tc/ 6 RL5406 | 21 | S | S | S | S | | Tc / 6 RL5404 | 22 | S | S | S | S | | Lee F 1310 / 6 Tc | 23 | R | S | S | S | | Tc6 / Agent | 24 | R | S | R | S | | Transec | 25 | S | S | S | S | | Кавказ | 26 | R | S | R | S | | Tc /6 CS7DIAg | 29 | S | S | S | S | | Tc 6 /Terenzio | 30 | S | S | S | S | | Tc7 / RL5497-1 | 32 | S | S | S | S | | Tc7 / Terenzio | 34 | S | S | S | S | | Rondeswous | 37 | R | S | S | R | | TAM 200 | 43 | R | S | R | R | | Bayden | | R | R | R | R | | Welton | | R | R | R | R | | Tomo | | R | R | R | R | | 5\37-91 | | R | R | R | R | | 2-3\99 | | R | R | S | S |
Таблица 3
Устойчивость сортов и линий озимой мягкой пшеницы к Puccinia recondita Rob ex
Desm f. sp. tritici
Фаза молочно-восковой спелости, 2003г
| Линия, сорт | Интенсивность поражения (балл) | | Раса 2 (изолят 2) | Раса 77 (изолят 29) | Раса 144 (изолят 97) | Раса 77 (изолят 15) | | Bayden | 9 | 8 | 8 | 9 | | Tomo | 8 | 8 | 8 | 8 | | Welton | 9 | 7 | 8 | 7 | | 5/37-91 | 9 | 9 | 9 | 9 | | 2-3/99 | 9 | 8 | 7 | 7 | | Michigan Amber * | 1 | 1 | 1 | 1 |
* Michigan Amber – индикатор очень высокой чувствительности
Линия ТАМ 200 с геном Lr43 восприимчива к расе 77 (изолят29), а сорта Tomo,
Welton, Bayden, линии 5/37-91 и 2-3/99 устойчивы. Это указывает на
неидентичность генов этих сортов и линий гену Lr43.
Растения F1 от скрещивания сортов Bayden, Welton, Tomo и линии 5/37-91 с
Одесской полукарликовой, к расе 144 (изолят 97) проявили устойчивость, а F1,
от скрещивания линии 2-3/99 с Одесской полукарликовой к расе 77 (изолят 29)
также проявило устойчивость (Табл.4, 6). Это указывает на то, что
устойчивость изучаемых сортов и линий контролируется доминантными генами.
В F2, от скрещивания сорта Bayden с Одесской полукарликовой, наблюдалось
фактическое отношение устойчивых и восприимчивых к возбудителю бурой листовой
ржавчины растений достоверно (c2 = 0,12), соответствующее отношению 3 : 1
(Табл. 4). Это указывает на то, что устойчивость сорта контролируется одним
доминантным геном. Этот результат подтверждается анализом первого поколения
от скрещивания гибрида (Bayden х Одесская полукарликовая) с Одесской
полукарликовой. В этом беккроссном поколении наблюдалось фактическое
отношение устойчивых и восприимчивых растений достоверно (c2 = 0,10),
соответствующее отношению 1 : 1, указывающее на наличие у сорта Bayden одного
доминантного Lr-гена (Табл. 5).
В F2 от скрещивания сорта Welton c Одесской полукарликовой наблюдалось
фактическое отношение устойчивых и восприимчивых растений достоверно (c2 =
0.01), соответствующее отношению 9 : 7 (Табл. 5). Это указывает на то, что
устойчивость сорта контролируется двумя комплементарно действующими генами.
Этот результат подтверждается анализом первого поколения от скрещивания
гибрида (Welton х Одесская полукарликовая) с Одесской полукарликовой. В этом
беккроссном поколении фактическое отношение устойчивых и восприимчивых
растений достоверно (c2 = 0,04), соответствующее отношению 1 : 3, указывающее
на
Таблица 4
Гибридологический анализ устойчивости сортов озимой мягкой пшеницы к
возбудителю бурой листовой ржавчины Puccinia recondita f.sp.tritici.
Ювенильная фаза 2002г.
Сорт, гибрид | Раса / изо-лят | Харак-терис-тика F1 и родите-льских форм | Соотношение устойчивых и восприимчивых фенотипов в популяции F2. | | Фактичес-кие | Теорети-чески ожидаемые | c2 | р | Коли-чес-тво генов | | R | S | R | S | | Bayden | 144/97 | R | | | | | | | | | Одесская полукарлико-вая | -//- | S | | | | | | | | | Bayden * Одесская полукарлико-вая | -//- | R | 137 | 43 | 3 | 1 | 0,12 | 0,50-0,75 | 1 | | Welton | -//- | R | | | | | | | | | Welton* Одесская полукарлико-вая | -//- | R | 73 | 60 | 9 | 7 | 0,01 | 0,75- 0,90 | 2 | | Tomo | -//- | R | | | | | | | | | Tomo * Одесская полукарлико-вая | -//- | R | 92 | 73 | 9 | 7 | 0,12 | 0,50- 0,75 | 2 |
Таблица 5
Гибридологический анализ устойчивости сортов озимой мягкой пшеницы к
возбудителю бурой листовой ржавчины Puccinia recondita f. sp. tritici.
Ювенильная фаза 2002г.
| Гибрид | Раса/ изо-лят | Соотношение устойчивых и восприимчивых фенотипов в F1 BC1 | | Фактические | Теоретически ожидаемые | c2 | Р | Коли-чество генов | | R | S | R | S | | Bayden* Одесская полукарликовая | 144/97 | 20 | 22 | 1 | 1 | 0.10 | 0.75-0.90 | 1 | | Welton * Одесская полукарликовая | -//- | 8 | 26 | 1 | 3 | 0.04 | 0.90-0.95 | 2 | | Tomo * Одесская полукарликовая | -//- | 10 | 27 | 1 | 3 | 0.06 | 0.90-0.95 | 2 |
наличие у сорта Welton двух доминантных комплементарно действующих Lr-генов
(Табл. 5).
В F2 от скрещивания сорта Tomo c Одесской полукарликовой наблюдалось
фактическое отношение устойчивых и восприимчивых растений достоверно (c2 =
0,12), соответствующее отношению 9 : 7 (Табл. 4). Это указывает на то, что
устойчивость сорта контролируется двумя комплементарно действующими генами.
Этот результат подтверждается анализом первого поколения от скрещивания
гибрида (Tomo х Одесская полукарликовая) с Одесской полукарликовой. В этом
беккроссном поколении наблюдалось фактическое отношение устойчивых и
восприимчивых растений достоверно (c2 = 0,06), соответствующее отношению 1 :
3, указывающее на наличие у сорта Tomo двух доминантных комплементарно
действующих Lr-генов (Табл. 5).
В F2, от скрещивания линии 5/37-91 с Одесской полукарликовой, наблюдалось
фактическое отношение устойчивых и восприимчивых растений достоверно (c2 =
0,74), соответствующее отношению 9:7 (Табл.6). Это указывает на то, что
устойчивость линии контролируется двумя комплементарно действующими генами.
Этот результат подтверждается анализом F1BC1 от скрещивания первого
поколения гибрида (5/37-91 х Одесская полукарликовая) с Одесской
полукарликовой. В этом беккроссном поколении наблюдалось фактическое
отношение устойчивых и восприимчивых растений достоверно (c2 = 0,44)
соответствующее теоретически ожидаемому отношению 1:3, что также указывает на
наличие у линии 5/37-91 двух доминантных комплементарно действующих Lr-
генов.
В F2 от скрещивания линии 2-3/99 с Одесской полукарликовой наблюдалось
фактическое отношение устойчивых и восприимчивых к возбудителю бурой листовой
ржавчины растений достоверно (c2 = 0.17) соответствующее отношению 3:1
(Табл.6). Это означает, что устойчивость линии контролируется одним
доминантным геном. Этот результат
Таблица 6.
Гибридологический анализ устойчивости линий озимой мягкой пшеницы к
возбудителю бурой листовой ржавчины Puccinia recondita f. sp tritici.
Ювенильная фаза 2003г.
| Сорт, гибрид | Раса/ изолят | Характерис-тика F1 и родитель-ских форм | Соотношение устойчивых и восприимчивых фенотипов в популяции F2 и F1BC1 | c2 | Р | Коли-чество генов | | фактические | теоретические | | R | S | R | S | | 5/37-91 (Одесская полукарликовая x Aegilops cylindrica) | 144/97 | R | | | | | | | | | 2-37/99 (Grana x Agatha) x Michigan Amber | 77/29 | R | | | | | | | | Одесская полукарликовая | 144/97 | S | | | | | | | | | 5/37-91 х Одесская полукарликовая | 144/97 | R | 85 | 57 | 9 | 7 | 0,74 | 0,25- 0,50 | 2 | | 2-3/99 х Одесская полукарликовая | 77/29 | R | 91 | 33 | 3 | 1 | 0,17 | 0,50- 0,75 | 1 |
подтверждается анализом F1BC1 от скрещивания линии 2-3/99 с Одесской
полукарликовой.
В этом беккроссном поколении отношение устойчивых и восприимчивых растений,
достоверно (c2 = 0.02), соответствовало отношению 1:1, что также указывает
на наличие у линии 2-3/ 99 одного доминантного гена устойчивости (Табл.7).
То, что линия 5/37-91 была получена в результате межвидовой гибридизации высоко
восприимчивого сорта Одесская полукарликовая и Aegilops cylindrica,
позволяет нам сделать вывод о том, что Lr-ген этой линии происходит от
Aegilops cylindrica. Неидентичность указанного гена известным Lr-генам
позволяет нам предполагать, что это новый, ранее неизвестный Lr-ген.
Анализ родословной линии 2-3/99 показывает, что она была получена в
результате внутривидовой гибридизации высоковосприимчивых сортов Grana и
Michigan Amber с устойчивым сортом Agatha. По литературным данным [McIntosh,
1998] известно, что устойчивость сорта Agatha контролируется геном Lr-19. Как
показывают наши исследования, показатели оценок устойчивости линий 2-3/99 и
Тс7/ Agatha с геном Lr19 к тестируемым расам патогена одинаковы (Табл.2). Это
указывает на то, что устойчивость линии 2-3/99 контролируется геном Lr19.
Таблица 7
Гибридологический анализ устойчивости озимой мягкой пшеницы к возбудителю
бурой листовой ржавчины Puccinia recondita Rob ex Desm f. sp. tritici
Ювенильная фаза, 2003 г
| Гибрид | Раса / изолят | Соотношение устойчивых и восприимчивых фенотипов в F1BC1 | | Фактические | Ожидаемые | c2 | Р | Количес-тво генов | | R | S | R | S | | 5/37-91 (Одесская полукарликовая х Aegilops cylindrica) х Одесская полукарликовая | 144 / 97 | 11 | 26 | 1 | 3 | 0,44 | 0,50 – 0,75 | 2 | | 2-3/99 ((Grana x Agatha) x Michigan Amber) х Одесская полукарликовая | 77 / 29 | 19 | 18 | 1 | 1 | 0,08 | 0,90 | 1 |
ЗАКЛЮЧЕНИЕ
В Селекционно-генетическом институте (СГИ) ведется селекция озимой мягкой
пшеницы на устойчивость к возбудителю бурой листовой ржавчины Puccinia
recondita Rob ex Desm f. sp. tritici, одного из самых распространенных и
вредоносных заболеваний этой культуры.
В селекционной работе, как доноры устойчивости, используются отечественные и
зарубежные сорта пшеницы и другой исходный селекционный материал, имеющий
эффективные Lr-гены.
Среди известных, количество эффективных Lr-генов ограничено, и их число с
каждым годом сокращается в результате появления в популяции патогена новых
вирулентных и агрессивных рас и биотипов, преодолевающих устойчивость.
Поэтому, среди селекционного и коллекционного материалов, постоянно ведется
поиск устойчивого, с эффективными Lr-генами, ко всем вирулентным и
агрессивным патотипам. Эти исследования весьма актуальны и значимы для
селекции пшеницы на устойчивость к возбудителю заболевания.
В результате выполненной дипломной работы, нами из коллекционного материала
выделены сорта озимой мягкой пшеницы Bayden, Tomo, Welton и селекционные
линии 5/37-91 и 2-3/99, обладающие высокой устойчивостью к этому патогену.
Для обоснованного их использования в селекции в качестве доноров
устойчивости, составления планов гибридизации и работы на дальнейших этапах
селекционного процесса следовало изучить генетические основы устойчивости
выявленных сортов и линий к основным вирулентным и наиболее агрессивным расам
патогена. Это стало целью настоящей дипломной работы, которая успешно была
выполнена.
В изученных сортах и линиях пшеницы выявлены как ранее не описанные Lr-гены,
так и известный ген Lr-19. на основании проведенных исследований нами сделаны
нижеследующие выводы и предположения.
ВЫВОДЫ
1. Сорта Bayden, Tomo, Welton и линия 5/37-91 обладают устойчивостью к
возбудителю бурой листовой ржавчины Puccinia recondita Rob ex Desm f. Sp
tritici как в ювенильной, так и в фазе взрослых растений (молочно-восковая
спелость). В то же время линия 2-3/99 в ювенильной фазе развития растений
устойчива к одним расам патогена (2/2; 77/29) и восприимчива к другим (144/97;
77/15), а в фазе взрослых растений устойчива ко всем расам.
2. Устойчивость сорта Bayden, а также линии 2-3/99 контролируется
одним доминантным геном устойчивости. Устойчивость сортов Tomo, Welton и линии
5/37-91 контролируется двумя доминантными комплементарно действующими
Lr-генами.
3. Гены линии 5/37-91 являются интрогрессивными и происходят от
Aegilops cylindrica.
4. Выявленные гены сортов и линии 5/37-91 вероятно являются новыми и
не идентичными Lr-генам 1, 2а, 2в, 2c, 3a, 3ka, 3bg, 9, 10, 11, 12, 13, 14a,
14b, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 29, 30, 32, 34, 37, 43. Их
происхождение следует установить.
5. Устойчивость линии 2-3/99 контролируется геном Lr-19.
Сорта Bayden, Tomo, Welton и линии 5/37-91 и 2-3/99 можно использовать в
селекции в качестве доноров высокоэффективных Lr-генов устойчивости.
ИСПОЛЬЗУЕМАЯ ЛИТЕРАТУРА
1. Бабаянц Л.Т. Вирулентность стеблевой ржавчины на
юго-западе Украины и устойчивость пшениц к заболеванию // IV съезд генетиков и
селекционеров Украины. – 1981. – 3. – С. 5 – 11.
2. Бабаянц Л.Т. Генетика устойчивости пшеницы к
основным болезням // Проблемы повышения устойчивости зерновых культур и
подсолнечника к болезням и вредителям. Сборник научных трудов ВСГИ. – 1990. –
С. 5 - 15 .
3. Бабаянц Л.Т., Мештерхази А., Вехтер Ф., и др.
Методы селекции оценки устойчивости пшеницы и ячменя к болезням в странах-членах
СЭВ. – Прага, 1988. – С. 125 - 169
4. Бабаянц Л.Т., Рибалка О.І., Аксельруд Д.В. Нове
джерело стійкості пшениці до основних хвороб // Реалізація потенційних
можливостей сортів та гібридів Селекційно-генетичного інституту в умовах
України : Зб. Наук. Пр. – Одеса, 1996. – С. 111 – 116.
5. Бабаянц Л.Т., Слюсаренко А.Н. Материал Всесоюзн.
конференции “Проблемы и пути повышения устойчивости растений к болезням и
экстремальным условиям среды в связи с задачами селекции”. Л., 1981. - С. 23.
6. Бублик Л.І., Васичко Г.І. та ін. / Довідник
захисту рослин / За ред. М.П. Лісового. – К.: Урожай, 1999. – 744 с.
7. Будашкина Е.Б., Дьяков Ю.Т., Жуковский П.М. и др.
Генетические основы селекции растений на иммунитет. М .: Наука, 1973. С. 120 –
134
8. Вавилов Н.И. Иммунитет растений к инфекционным
заболеваниям. – М.: Наука, 1986. – 520 с.
9. Ван Дер Планк. Устойчивость растений к болезням.
М.: Колос, 1972. 154с.
10. Гешеле Э.Э. Основы фитопатологической оценки в селекции
растений. М.: Колос, 1978. С. 53
11. Збірник наукових праць Селекційно-генетичного інституту / під
редакцією Крижанівського В.Я. - Одеса: СГІ, 1999. – С. 1 – 146.
12. Крижановский В.Я., Лозийчук А.П. /Авторы составители/
Каталог сортов и гибридов Всесоюзного селекционно – генетического института –
Одесса: ВСГИ, 1983.
13. Лесовой М.П., Суворова Г.С. состав и специализация рас
возбудителя бурой ржавчины пшеницы на Украине // Защита растений : Респ,
межвед. тем. сб. – Киев, 1990. – Вып. 31 – С. 3 – 7.
14. Лобашев М.Е. Генетика: издание второе. Учебное пособие
для биологических факультетов университетов, 1967.
15. Метлицкий Л.В., Дьяков Ю.Т., Озерецковская О.Л. Доклады
АН УССР 213. №1. – 1973 – С.209.
16. Метлицкий Л.В., Озерецковская О.Л. Доклады АН
УССР. - №1. – 1976. – С. 227.
17. Метлицкий Л.В., Озерецковская О.Л. Как растения защищаются от
болезней. М.: Наука. – 1985 – 192 с.
18. Мірось С.Л. Генетична детермінація ознаки стійкості
озимих м яких пшениць півдня України до збудника фузаріозу колоса (Fusarium
graminearum Shwabe): Дисс. ... кандидата біол. наук. – Одеса. 2003. – 156с.
19. Одинцова И.Г., Михайлова Л.А. Ограничения для применения
метода идентификации генов устойчивости к болезням с помощью клонов
фитопатогенов с известной вирулентностью // Труды по прикладной ботанике,
генетике и селекции ВНИИ растениеводства. – 1982. – 71 – 3. С. 35 – 40.
20. Пересыпкин В.Ф. Болезни зерновых культур. – М: Колос, 1979. – 279 с.
21. Попереля Ф. А., Бабаянц Л. Т. Блок компонентов глиадина
IB3 как маркер гена, обусловливающего устойчивость растений пшеницы к стеблевой
ржавчине // Докл. ВАСХНИЛ. – 1978. – С. 6 – 8.
22. Рачинский Т, Донцев Н. Унаследявана устойчивоста на
пшеницата сорт №234 към физиологическите раси 13, 21, 55, 77, 11, 122 на
кафявата ръжда . Проблемы селекции. – София, 1969. – С. 237 – 242.
23. Рокицкий П.Ф. Биологическая статистика. – Минск :
«Вышейшая школа», 1973. – С.319.
24. Тоцький В.М. Генетика. – Одеса: Астропринт, 2002. – 712 с.
25. Щербаков В.К. В сб. Итоги науки. Биологические основы
растениеводства // Генетика, селекция, интродукция и защита
сельскохозяйственных растений. – М.: ВИНИТИ. 1970. – С. 111.
26. Щербаков В.К. Использование индуцированного иммунитета в
селекции растений. – М., 1973. – С. 112.
27. Anderson R.G. The inheritance of leaf rust resistance in
seven varieties of common wheat //Canad. J. Pl. Sci. – 1961. – V 41,
P. 342 – 359.
28. Ausemus E.R., Harrington Y.B., Worzella W.W., Reitz L.P.
A summary of genetic studies in hexaploid and tetraploid wheats // J. Amer. Soc.
Agron. – 38. – 1946. – P. 1082 – 1099.
29. Bariana H.C. and McIntosh R.A/ Genetic Studies on Stripe
Rust Resistance in Wheat //Thesis, University of Sydney. – 1991. - P. 115.
30. Biffen R.H. Mendels laws of inheritance and wheat
breeding // J. Agric. Sci. – 1905. – P. 4 – 48
31. Biffen R.H. Studies in the inheritance of disease
resistance // J. Agric. Sci. – 1907. – V.2 – P. 109 – 128.
32. Browder L.E. Designation of two genes for resistance to Puccinia
recondita in Triticum aestivum // Crop Science. 1972. – V.12. – P. 705 – 706.
33. Browder L.E. Probable genotype of some Triticum aestivum
“Agent” derivatives for reactions to Puccinia recondita f. sp. tritici // Crop
Sci. – 1973. – 13. – P. 203 – 206
34. Cox T.S., Raupp W.I., Gill B.S. Leaf rust-resistance
genes Lr 41, Lr 42 and Lr 43 transferred from Triticum taushii to common wheat
// Crop Sci. – 1994. – 34. – P. 339 – 343.
35. Dvorak J., Resta P. and Kota R.S. Molecular evidence on
the origin of wheat chromosome 4A and 4B // Genome. -1990. – V. 33. – P. 30 –
39.
36. Dyck P.L. Identification of the gene for adult plant
leaf rust resistance in Thatcher // Canadian Journal of Plant Science. – 1979.
– V. 59. – P. 499 – 501.
37. Dyck P.L. Transfer of a gene for stem rust resistance
from Triticum araraticum to hexaploid wheat // Genome. – 1992. –V. 53. – P. 788
– 792.
38. Dyck P.L. and Kerber E.R. Chromosome location of three
genes for leaf rust resistance in common wheat // Canadian Journal of Genetics
and Cytology. – 1971. – V. 13. – P. 480 – 483.
39. Dyck P.L. and Kerber E.R. Inheritance of leaf rust
resistance in wheat cultivars Rafaela and EAP 26127 and chromosome location of
gene Lr 17 // Canadian Journal of Genetics and Cytology. – 1977a. – V.19. – P.
355 – 358.
40. Dyck P.L. and Kerber E.R. Aneuploid analysis of a gene
for leaf rust resistance derived from the common wheat cultivar Terenzio //
Canadian Journal of Genetics and Cytology. – 1981 – V.23. – P. 405 – 409.
41. Dyck P.L., Samborski D.J. Inheritance of virulence in
Puccinia recondita of alleles at the Lr 2 locus for resistance in wheat //
Canadian Journal of Genetics and Cytology. – 1974. – V. 16. – P. 323.
42. Dyck P.L., Samborski D.J. Inheritance of virulence in
Puccinia recondita of alleles at the Lr 2 locus for resistance in wheat //
Canadian Journal of Genetics and Cytology. – 1974. – V. 16. – P. 323.
43. Dyck P.L., Samborski D.J. and Anderson R.G. Inheritance
of adult plant leaf rust resistance derived from the common wheat varieties
Exchange and Frontana // Canadian Journal of Genetics and Cytology. – 1966. –
V.8. – P. 665 – 671.
44. Favret E.A., Cenoz H.P., Silvero O.J., Solari R.M.,
Mujika F.L. Plants Mutation Vienna // LAEA. – 1969. – 123p.
45. Favret E.A. Personal communication. 1979.
46. Flor H.H. Current status of gene-for-gene conception //
Annual Review of Phytopathology, 1971, – P. 275 – 298.
47. Friebe B., Zeller F.J., Mukai Y., Forster B.R., Bartos P.
and McIntosh R.A. Characterization of rust resistant wheat – Agropyron
intermedium derivatives by C-banding, in situ hybridization and isozyme
analysis // Theoretical and Applied Genetics. – 1992. V. 83. – P. 141 – 149.
48. Hawthorn W.M. Genetic Analyses of Leaf Rust Resistance
in Wheat // PhD Thesis, University of Sydney. – 1984. P. 43.
49. Heiterfuss R. Tagungsberichtung № 74. – 1965. – 254p.
50. Johnson R. Durable resistance, definition of, genetic
control, and attainment in plant in plant breeding // Phytopathology. V. 71. –
P.567 – 568.
51. Johnson R. Genetics of the interaction between plants
and their parasites // In naturals Antimicrobial Systems. – 1986. – Part 1. P
35 – 37.
52. Kerber E.R. Resistance to leaf rust in hexaploid wheat,
Lr 32 a third gene derived from Triticum taushii // Crop Science. – 1987. – V.
27. P. – 204 – 206.
53. Kerber E.R. and Dyck P.L. Transfer to hexaploid wheat of
linked genes for adult-plant leaf rust and seedling stem rust resistance from
an amphiploid of Aegilops speltoides x Triticum monococcum // Genome. -1990. –
V. 33. – P. 530 – 537.
54. Luig N.H. and McIntosh R.A. Location and linkage of
genes on wheat chromosome 2D // Canadian Journal of Genetics and Cytology. –
1968. – V.10. – P.99 – 105.
55. McIntosh R.A. Genetic and cytogenetic studies involving
Lr 18 for resistance to Puccinia recondita // In Proceedings of the Sixth
International Wheat Genetics Symposium. – 1983. – P. 777 – 783.
56. McIntosh R.A. Catalogue of gene symbols for wheat //
Proceedings of the Seventh International Wheat Genetics Symposium. Institute of
Plant Science Research: Cambridge, UK. – 1988. Vol.2. – P. 1225 – 1323.
57. McIntosh R.A. Catalogue of gene symbols for wheat. Vol.5
1998. – P. 134 – 139
58. McIntosh R.A. and Baker E.P. Chromosome location of
mature plant leaf rust resistance in Chinese Spring wheat // Australian Journal
of Biological Sciences. – 1966. - V. 19. – P. 943 – 944.
59. McIntosh R.A., Baker E.P., Driscoll C.J. Cytogenetic
studies in wheat. I Monosomic analysis of leaf rust resistance in cultivars
Uruguay and Transfer // Australian Journal of Biological Sciences. – 1965. V.
18. – P. 971 – 977.
60. McIntosh R.A., Dyck P.L. Gene Lr 23 for reaction to
Puccinia recondita in Gabo and related cultivars // Australian Journal of
Biological Sciences. – 1975. – V.28., 2. – P. 201 – 211.
61. McIntosh R.A., Dyck P.L. and Green G.J. Inheritance of
leaf rust and stem rust resistances in wheat cultivars Agent and Agatha //
Australian Journal of Agricultural Research. – 1976. – V. 28. – P. 37 – 45.
62. McIntosh R.A., Hart G.E. and Gale M.D. Catalogue of gene
symbols for wheat // Wheat Information Service. – 1989. V. 69. – P. 49 – 63.
63. McIntosh R.A., Luig N.H. and Baker E.P. Genetic and
cytogenetic studies of stem rust, leaf rust and powder mildew resistances in
Hope and related wheat cultivars // Australian Journal of Biological Sciences.
– 1967. – V. 20. – P. 1181 – 1192.
64. McIntosh R.A. and Singh S.J. Rusts – Real an potential
problem for triticale // In Proceedings of the International Triticale
Symposium. Occasional Publication. – 1986. No. 24. – P. 199 – 207.
65. McIntosh R.A., Wellings C.R., Park R.F. Wheat rust: An
atlas of Resistance Genes. – Dordrecht: Kluwer Acad. Publ., 1995. – P 29 – 82.
66. Mettin D., Bluthner W.D. and Shlegel G. Additional
evidence on spontaneous 1B/1R wheat-rye substitutions and translocations // In
Proceedings of the Fourth International Wheat Genetics Symposium. – 1973. – P.
179 – 184.
67. Person C. gene-for-gene relationship in host parasite
systems // Can. J. Bot. – 1969. – P. 1101 – 1130.
68. Rowland G.G. and Kerber E.R. Telocentric mapping in
hexaploid wheat of genes for leaf rust resistance and other characters derived
from Aegilops squarrosa // Canadian Journal of Genetics and Cytology. – 1974. -
V. 16. – P. 137 – 144.
69. Samborski D.J. and Dyck P.L. Inheritance of virulence in
Puccinia recondita on six backcross lines of wheat with single genes for
resistance to leaf rust // Canadian Journal of Botany. – 1976. – V. 54. – P.
1666 – 1671.
70. Sharma D. and Knott D.R. The transfer of leaf rust
resistance from Agropyron to Triticum by irradiation // Canadian Journal of
Genetics and Cytology. – 1966. – V. 8. – P. 137 – 143.
71. Singh R.P. and McIntosh R.A. Complementary genes for
resistance to Puccinia recondita tritici in Triticum aestivum I. Genetic and
linkage studies // Canadian Journal of Genetics and Cytology. – 1984a. – V. 26.
– P. 723 – 735.
72. Singh R.P. and McIntosh R.A. Complementary genes for
resistance to Puccinia recondita tritici in Triticum aestivum II. Cytogenetic
studies // Canadian Journal of Genetics and Cytology. – 1984b. – V. 26. – P.
736 – 742.
73. Smith E.L., Schlehuber A.M., Young H.C.Jr. and Edwards L.H
. Registration of agent wheat // Crop Science. – 1968. – V. 8. – P. 511 – 512.
74. Soliman A.S., Heyne E.G. and Johnston C.O. Genetic
analysis of leaf rust resistance in eight differential varieties of wheat //
Crop Science. – 1964. – V. 4. – P. 246 – 248.
75. Watson I.A. and Luig N.H. Progressive increase in
virulence in Puccinia recondita f. sp. tritici // Phytopathology. – 1968. – V.
58. – P. 70 – 73.
| 